Metastasiertes Urothelkarzinom
mUC nach Immuntherapie
Monotherapie mit XL-092
A Dose-Escalation and Expansion Study of the Safety and Pharmacokinetics of XL092 as Single-Agent and Combination Therapy in Subjects with Inoperable Locally Advanced or Metastatic Solid Tumors
Welche Patientengruppe wird in die Studie eingeschlossen?
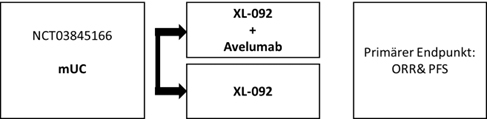
Patienten mit einem metastasierten Urothelkarzinom, bei denen ein Fortschreiten der Erkrankung unter oder nach Therapie mit einem Checkpoint-Inhibitor festgestellt wurde.
Welche Vortherapien sind erlaubt?
- Max. 2 Vortherapien
Welche Vortherapien sind nicht erlaubt?
- Vorherige Therapie mit Avelumab
Gibt es Ausschlusskriterien für die Studie?
- Orale Antikoagulation
- Bekannte Autoimmunerkrankungen
- Herzinsuffizienz ≥ NYHA III
- Fortgeschrittene Niereninsuffizienz (GFR < 45 ml/min)
Wie funktioniert die Phase-I Studie?
In dieser Phase I Studie erhalten Patienten nach dem Zufallsprinzip entweder eine Monotherapie mit XL-092 oder eine Kombinationstherapie aus XL-092 und Avelumab.
Was für eine neue Tumortherapie wird untersucht?
Es wird ein neuer Multikinase-Inhibitor, XL-092, untersucht. XL-092 greift gezielt die Tumorzellen und das umlegende Gefäßsystem an. Über die Störung des Tumorwachstums und die Hemmung von neuen Tumorgefäßen können Tumorzellen sich nicht ausreichend mit Nährstoffen versorgen und sterben ab. Die Hinzunahme von Avelumab führt zusätzlich zu einer Aktivierung des eigenen Immunsystems gegen die Krebszellen.
Wie wird die Therapie eingenommen?
Patienten nehmen XL-092 täglich zuhause sowie an Behandlungsterminen in der Klinik als Tablette ein. Die Immuntherapie mit Avelumab wird alle 2 Wochen als Infusion ambulant verabreicht.
Wie ist die Studie aufgebaut?
Wo finde ich ausführliche Informationen:
www.clinicaltrials.gov NCT038845166
